Gerahmter Warnhinweis für Retinoide
Teratogenes Risiko und neuropsychiatrische Nebenwirkungen: Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) setzt den Durchführungsbeschluss der EU-Kommission für orale und topische Retinoide um. Verpflichtend ist ein gerahmter Warnhinweis auf der äußeren Verpackung.
Im Juli 2016 startete auf Ersuchen Großbritanniens ein Risikobewertungsverfahren zu Retinoiden. Dieses fand seinen Abschluss im März dieses Jahres. Acitretin, Adapalen, Alitretinoin, Bexaroten, Istotretinoin, Tazaroten und Tretinoin sind die überprüften und bewerteten Wirkstoffe, die als orale beziehungsweise topische Zubereitungen auf dem Markt sind und zur Behandlung verschiedener Hauterkrankungen wie Akne oder Psoriasis sowie bestimmter Krebserkrankungen eingesetzt werden.
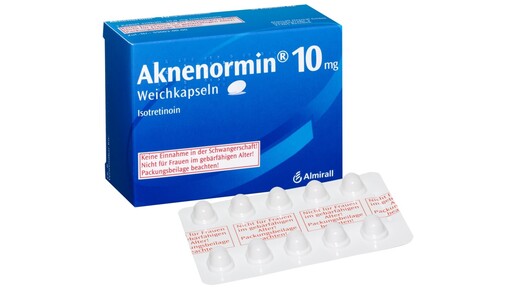
Oral einzunehmende Retinoide können das ungeborene Kind schädigen. Für entsprechende Arzneimittel mit Acitretin, Alitretinoin und Isotretinoin gilt daher eine Kontraindikation in der Schwangerschaft. Fach- und Gebrauchsinformation sollen ein schwarzes Dreieck tragen und um entsprechende Warnhinweise und Informationen zum Schwangerschaftsverhütungsprogramm ergänzt werden. Auf der äußeren Verpackung soll ein umrandeter Warnhinweis – jedoch kein Piktogramm – seinen Platz finden. Dieser gerahmte Warnhinweis zum teratogenen Risiko und der Notwendigkeit einer effektiven Empfängnisverhütung soll spätestens ab dem 21. September dieses Jahres auf der äußeren Verpackung aufgebracht werden.
Frauen im gebärfähigen Alter sollen orales Acitretin, Alitretinoin und Isotretion zur Behandlung von Hauterkrankungen nur unter Einhaltung des aktualisierten Schwangerschaftsverhütungsprogramms angewendet werden. Die Arzneimittel dürfen von der Risikogruppe nur eingenommen werden, wenn vor, während und fünf Wochen nach Beendigung der Retinoid-Behandlung Schwangerschaftstests durchgeführt werden und im selben Zeitraum eine effektive Schwangerschaftsverhütung vorgenommen wird. Außerdem ist Schulungsmaterial zum Schwangerschaftsverhütungsprogramm entsprechend den EU-weit verabschiedeten Vorgaben bereitzustellen. Das BfArM empfiehlt den pharmazeutischen Unternehmen in puncto Erstellung des Schulungsmaterials zu kooperieren und lediglich einen Vorschlag bei der Behörde einzureichen.
Die Patientin sollte seit mindestens einem Monat vor Therapiebeginn eine oder vorzugsweise zwei Methoden der effektiven Empfängnisverhütung, inklusive einer Barrieremethode nutzen und diese während der Behandlungszeitraums sowie einen Monat darüber hinaus durchführen. Ein Bestätigungsformular soll die erfolgte Beratung der Frauen dokumentieren. Für die Retinoide Bexaroten und Tretinoin, die zur Behandlung verschiedener Krebsarten eingesetzt werden, sehen die Experten ein Schwangerschaftsverhütungsprogramm als unnötig an. Bexaroten wird beispielsweise zur Behandlung des kutanen T-Zell-Lymphoms eingesetzt. Hier sind jedoch Warnhinweise zu neuropsychiatrischen Nebenwirkungen zu ergänzen.
Topisch angewendete Retinoide sind analog zu oralen Retinoiden in bestehender oder geplanter Schwangerschaft kontraindiziert. Hierbei handelt es sich jedoch um einer Vorsichtsmaßnahme, denn die Experten stufen das Risiko für das ungeborene Kind als weniger gefährlich ein. Die über die Haut aufgenommene Wirkstoffmenge könne vernachlässigt werden. Das die Produkte im Mutterleib Schaden verursachen können, sei unwahrscheinlich.
Die Packungsbeilagen oral angewendeter Retinoide sollen künftig einen Warnhinweis für das Risiko von neuropsychologischen Erkrankungen wie Depressionen und Ängsten einschließlich Anzeichen und Symptomen wie Verhaltensstörungen und Stimmungsschwankungen enthalten. Topische Retinoide sind von der Erweiterung ausgenommen.
Außerdem ist eine Anwendungsstudie gefordert, deren Ergebnisse dem BfArM in Berichtsform bis zum 21. Juni 2022 zu übermitteln sind. Das Studiendesign sollte darauf abzielen, die Wirksamkeit der Risikomanagementmaßnahmen zu bewerten und zu quantifizieren.

























APOTHEKE ADHOC Debatte