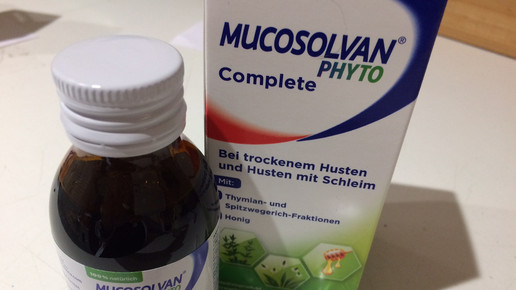
Naturalis: Zweite Chance für Mucosolvan Phyto Complete
Unter dem Namen Naturalis bringt Sanofi die aus Mucosolvan Phyto Complete bekannte Kombination aus Thymian, Spitzwegerich und Honig wieder auf den Markt. Dass das ursprünglich von Aboca entwickelte Medizinprodukt nach der überstürzten Rückrufaktion vor zweieinhalb Jahren eine zweite Chance bekommt, verdankt der Hersteller einer Entscheidung des Oberlandesgerichts Frankfurt (OLG), das sich an eine Stellungnahme des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) gebunden sah.
Der Schutzverband gegen Unwesen in der Wirtschaft hatte Anfang 2019 eine einstweilige Verfügung gegen Sanofi erwirkt, weil aus seiner Sicht kein Medizinprodukt, sondern ein zulassungspflichtiges Arzneimittel vorlag: Einerseits sei das Produkt wie ein Arzneimittel aufgemacht (Präsentationsarzneimittel), andererseits sei auch von einer pharmakologischen Wirkung auszugehen (Funktionsarzneimittel). Im Eilverfahren gaben Landgericht und OLG Frankfurt dem Kontrollverein recht. Der Konzern musste den erst wenige Monate zuvor eingeführte Hustensaft daraufhin vom Markt nehmen.
In der Folge stellte das Regierungspräsidium Darmstadt aber beim BfArM einen Antrag auf Einstufung des Produkts. Der Bescheid fiel zugunsten von Sanofi aus: Zwar ging auch die Behörde davon aus, dass es sich im Grundsatz um ein klassisches Präsentationsarzneimittel handele, das als solches einer Zulassung bedürfe. Dies wurde jedoch in derselben Stellungnahme dahingehend relativiert, dass noch weitere objektive Umstände vorliegen müssten, um im Rahmen einer Gesamtbetrachtung das Vorliegen eines Präsentationsarzneimittels bejahen zu können. Im konkreten Fall handele es sich daher doch nicht um ein zulassungspflichtiges Arzneimittel.
An diese Einschätzung sahen sich nun auch die Richter gebunden. Die Entscheidung sei zwar vielleicht unschlüssig und womöglich auch fehlerhaft, aber nicht „schlechterdings unerträglich“. Nur wenn ein behördlicher Verwaltungsakt „mit tragenden Verfassungsprinzipien oder der Rechtsordnung immanenten wesentlichen Wertvorstellungen unvereinbar erscheine“ und von niemandem erwartet werden könne, ihn als verbindlich anzuerkennen, könne er nach Rechtssprechung des Bundesverwaltungsgerichts (BVerwG) für nichtig erklärt werden.
Die Frage, ob er im konkreten Fall inhaltlich rechtmäßig ergangen sei, sei daher für die Tatbestandswirkung irrelevant. „Im Gegenteil: Es ist sogar gerade der Sinn der Tatbestandswirkung, dass die fachlich kompetente Verwaltungsbehörde eine abschließende Entscheidung trifft, die von den Zivilgerichten – unabhängig von der Rechtmäßigkeit – nicht nachprüfbar ist. Dies schließt die Akzeptanz ‚falscher‘ Entscheidungen grundsätzlich ein.“ Mit dieser Regelung, so das OLG weiter, solle „zur Herbeiführung der Rechtsklarheit ein einheitlicher Vollzug des Arzneimittelgesetzes (AMG) bei den einzelnen Landesvollzugsbehörden in diesen Grundsatzfragen gewährleistet und damit sich widersprechende Entscheidungen der Landesbehörden für identische Sachverhalte vermieden werden“.
Stattdessen könnten behördliche Entscheidungen vor den Verwaltungsgerichten einer Rechtmäßigkeitskontrolle zugeführt werden. „Eben hierin liegt die Rechtfertigung dafür, von einer Überprüfung des Bescheids im wettbewerbsrechtlichen Verfahren abzusehen ist“. Das OLG weist darauf hin, dass dies auch drittschützenden Charakter habe, sodass Wettbewerber auf diesem Weg die Entscheidung des BfArM angreifen könnten.
Die Richter teilen allerdings auch die Einschätzung des BfArM, dass der Status als Präsentationsarzneimittel nicht allein an der Frage festzumachen ist, welchen Zwecken das Produkt aus Verbrauchersicht dient. „So müssten viele stoffliche Medizinprodukte und ergänzende bilanzierte Diäten wegen ihrer medizinischen Zweckbestimmung und Präsentation als Arzneimittel eingestuft werden.“
Auch mit dem Vorwurf der Irreführung drang der Schutzverein nicht durch: So sei nicht davon auszugehen, dass Verbraucher erwarteten, dass ein als Medizinprodukt angebotenes Produkt tatsächlich die Voraussetzungen für Medizinprodukte erfülle, so das OLG. „Derartige Erwartungen hat der weder medizinisch noch juristisch vorgebildete Verkehr nicht. Er wird vielmehr erwarten, dass die Beklagte das Produkt rechtmäßig als Medizinprodukt vertreibt, das heißt dass die Zulassungsbehörde das Produkt als Medizinprodukt eingestuft hat.“
Vor zwei Jahren hatte das BVerwG im Zusammenhang mit Ginkgo entschieden, dass selbst bei Funktionsarzneimitteln – also unter bei anzunehmenden pharmakologischer Wirkung – unter bestimmten Umständen eine Relativierung erforderlich ist: „Liegen die Auswirkungen eines Produkts auf die physiologischen Funktionen im Grenzbereich zwischen Nahrungsergänzungs- und Arzneimittel, kommt dem Merkmal der Verwendungsrisiken besonderes Gewicht zu. Eine Einstufung als Arzneimittel ist insoweit nur gerechtfertigt, wenn dies zum Schutz der menschlichen Gesundheit erforderlich ist.“




















APOTHEKE ADHOC Debatte