Der Preis des Auseinzelns
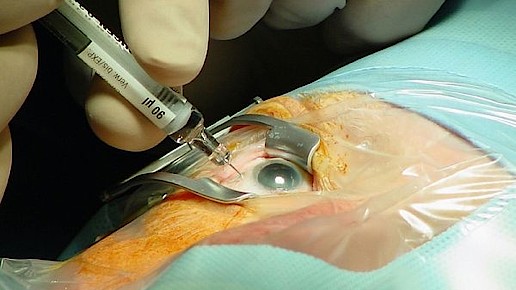
Ausgeeinzelte Fertigspritzen mit Lucentis, Eylea oder Avastin bringen den Kassen jedes Jahr Einsparungen in Millionenhöhe. Trotzdem steht die Konfektionierung vor dem Aus – mit gravierenden Folgen: Wenn sich die Auffassung des Hamburger Landgerichts durchsetzt, könnten zahlreiche patientenindividuell zubereitete Sterilrezepturen ohne Zulassung nicht mehr in Verkehr gebracht werden. Den Apotheken droht ein Nervenkrieg.
Wenn die Richter die Auseinzelung verbieten, ist das ein Freibrief für die Hersteller, die Preise zu gestalten wie sie wollen. Dass das ausgenutzt wird, zeigt bereits das Beispiel von Avastin, das bis zur Zulassung des deutlich teureren Lucentis zur Behandlung der altersabhängigen Makula-Degeneration (AMD) eingesetzt wurde. Trotzdem hat Hersteller Roche keine Zulassung für sein Präparat beantragt – womöglich, weil Novartis knapp ein Drittel der Aktien hält.
Mit dem Auseinzeln von Augenmedikamenten sparen die Kassen dem beklagten Apotheker Hermann Rohlfs zufolge rund 400 Millionen Euro im Jahr. Doch hier gilt das Gleiche wie beim Off-label-Use: Das Bundessozialgericht (BSG) hat im vergangenen Jahr entschieden hat, dass Patienten auf die Behandlung mit dem Originalpräparat bestehen können. Das Sparen darf nicht über dem Arzneimittelrecht stehen. Dennoch haben die Krankenkassen ein Interesse daran.
Schwierig wird es allerdings, wenn sich daraus ein eigener, unregulierter Geschäftszweig entwickelt – zwischen Herstellung und Rezeptur. Denn es kann durchaus angezweifelt werden, ob die massenhafte Herstellung von ausgeeinzelten Spritzen überhaupt noch dem Sinn und Zweck einer Rezeptur entspricht – bei einem individuellen Handlungsbedarf einem besonderen medizinischen Bedürfnis Rechnung zu tragen.
Anders als bei Zytostatika-Zubereitungen, die exakt auf die Bedürfnisse und die Lebenssituation des Erkrankten angepasst werden, wird bei Eylea und Lucentis lediglich die vom Hersteller vorgegebene Dosis abgefüllt. Auch wenn das individuell und nur auf Rezept geschieht, wären die einzelnen Fertigspritzen letztlich austauschbar.
Um die Entstehung einer pharmazeutischen Parallelwelt zu verhindern, war es vielleicht genau das Richtige, per EU-Verordnung für bestimmte Arzneimittel und Wirkstoffe eine Zulassung vorzuschreiben und somit die Auseinzelung zu verbieten. Schließlich gibt es keinen medizinischen Grund, die Original-Durchstechfläschchen auszueinzeln, sondern nur einen finanziellen. Und es stellt sich natürlich auch die Haftungsfrage, wenn das abgegebene Arzneimittel nicht mehr das Gleiche ist, das die Produktionsstätte verlassen hat.
Ganz abgesehen davon sind die Hamburger Richter mit ihrer Auslegung des EU-Rechts aber über das Ziel hinausgeschossen. Denn indem sie das Rezepturprivileg für bestimmte Wirkstoffe negieren, schaffen sie einen ganzen Markt ab. Inklusive unstreitbar notwendiger patientenindividueller Sterilrezepturen. Eine Zulassung für jedes Arzneimittel zu erhalten, ist schlicht unmöglich.
Bayer und Novartis wollten die Debatte keineswegs so grundsätzlich verstanden wissen und argumentieren, in den Fachinformationen sei die Verwendung der Arzneimittel für Zubereitungen vorgesehen. Daher brauche es dafür natürlich keine Zulassung. Nur die Restmengenverwertung wäre dann noch ein Problem, aber das beträfe ja wieder nur das Sparen. Doch die Richter schienen nicht so überzeugt von dieser Interpretation: Vielleicht sei die Verordnung genau so gedacht, dass es für solch kritische Wirkstoffe eben keine Rezepturen gebe. Punkt.
Die einzige Ausnahme, die die Richter zulassen, ist eine Verarbeitung, bei der das Ausgangsarzneimittel nicht verändert wird. Diese Forderung ist ist allerdings kaum erfüllbar, zumal noch offen ist, was genau eigentlich nicht verändert werden darf. In der Vorlagefrage des Hamburger Gerichts an den Europäischen Gerichtshof (EuGH) war noch von der Zusammensetzung des Arzneimittels die Rede – die sich bei der Auseinzelung tatsächlich nicht ändert. Inzwischen schauen die Richter aber auch auf andere Aspekte, etwa die Art der verwendeten Spritzen oder die Haltbarkeit. Da sich diese beim Abfüllen änderten, brauche es eine Zulassung.
Bei einer Rezeptur ändert sich jedoch noch viel mehr. Und das bedeutet letztlich ein Verbot von Zubereitungen mit den betroffenen Wirkstoffen. Mit Blick auf patientenindividuelle Sterilrezepturen ist das dramatisch. Aber selbst bei der Auseinzelung von Fertigspritzen kann durchaus hinterfragt werden, ob den Patienten wirklich mehr geholfen ist, wenn ein Arzt die Spritze in seiner Praxis aufzieht, als wenn dies Apotheker als Fachleute für Arzneimittel übernehmen. Ganz abgesehen vom Preis.





































APOTHEKE ADHOC Debatte