FDA: Neue Hinweise zu Abtreibungspille
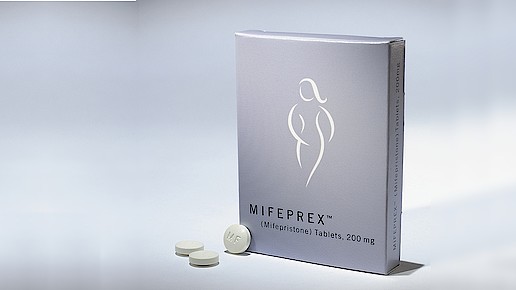
Die US-Zulassungsbehörde FDA erleichtert Frauen den Zugang zur Abtreibungspille Mifeprex (Mifepriston, Danco). Mit der Änderung der Fach- und Gebrauchsinformationen stellt sich die Behörde gegen die restriktiven Gesetze einiger US-Bundesstaaten – und folgt der auch hierzulande gängigen Praxis.
In den neuen Vorgaben wird die empfohlene Dosis von 600 mg auf 200 mg herabgesetzt. Weiterhin wird die Anwendung der Medikation auf bis zu 70 Tage nach Schwangerschaftsbeginn ausgeweitet – drei Wochen länger als zuvor. Zusätzlich erleichtert die FDA Ärzten den Umgang mit der Verordnung: So ist es nun auch möglich, dass das Pflegepersonal die Verabreichung des Medikamentes vornimmt.
Mit den Änderungen würden die Anwendungshinweise an die klinische Realität angepasst, hieß es. In den meisten Gegenden der USA ändere sich durch die neuen Vorgaben nichts: Der Großteil der Ärzte hatte den Umgang mit der Abtreibungspille bereits entsprechend gehandhabt und damit das Präparat „off-label“ verwendet. In einigen Staaten wie Ohio, Texas oder North Dakota gibt es jedoch eigene Gesetze, die die Mediziner zu einer Anwendung von Mifeprex gemäß den FDA-Vorgaben verpflichtet.
In der Vergangenheit hatten Abtreibungsgegner die Ärzte mit Hinweis auf die FDA-Vorgaben massiv kritisiert und gefordert, die Pille in geringerem Umfang zu verschreiben. Mifeprex in Kombination mit dem Prostaglandin Misoprostol gilt als sichere und deutlich weniger aufwändige Methode der Abtreibung als die operative Entfernung des Fötus. Entsprechend war die Beliebtheit der Abtreibungspille in den letzten Jahren kontinuierlich gestiegen.
„Die Änderung der Vorgaben erlaubt es uns endlich, den betroffenen Frauen eine echte Alternative anzubieten“, sagt Chrissie France, Direktorin der größten Abtreibungsklinik von Ohio. „Wir sind nicht mehr gezwungen, medizinische Eingriffe vorzunehmen, die nicht nur teurer, sondern potenziell auch gefährlicher sind als die Einnahme einer Tablette.“
Seit 2011 war die Verwendung von Mifeprex in Ohio durch die politische Intervention stark eingeschränkt worden – die Rate der medikamentösen Abtreibung war von 13 auf 2 Prozent zurückgegangen. Jetzt wird allgemein von einem deutlichen Anstieg der Verwendung der Abtreibungspille ausgegangen. Ärzte hätten durch die Regelungen mehr Sicherheit in der Anwendung und klarere Vorgaben.
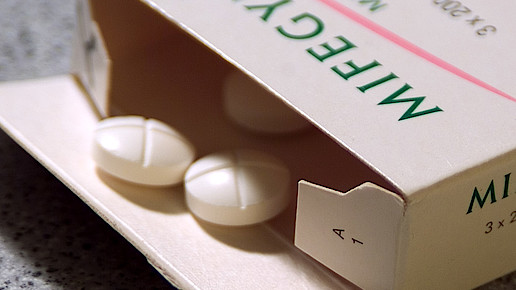
In den USA wird etwa jede vierte Schwangerschaftsabbruch durch Medikamente herbeigeführt. In Deutschland verwenden Ärzte bei jeder fünften Frau mit Abtreibungswunsch das Präparat Mifegyne. Mifegyne darf vom Hersteller nur direkt an Krankenhäuser oder Arztpraxen geliefert und nicht über den Großhandel oder die Apotheke an den Arzt abgegeben werden.
Seit 2008 wird Mifegyne in Deutschland vom skandinavischen Pharmahersteller Nordic vertrieben. Zulassungsinhaber ist das französische Unternehmen Exelgyn, das die Rechte 1997 von der Hoechst-Tochter Roussel-Uclaf übernommen hatte.
Mifepriston war im April 1980 als potenzieller Glucocorticoid-Rezeptorantagonist entwickelt worden; nachdem der antagonistische Effekt auf Progesteron erkannt wurde, begannen im Oktober 1981 erste Studien für den Einsatz zum Schwangerschaftsabbruch am Universitätsspital in Genf.
Nach Studien mit mehr als 20.000 Frauen wurde im Oktober 1987 der Zulassungsantrag gestellt, doch als ein Jahr später der positive Bescheid vorlag, hatten die Hoechst-Aktionäre kalte Füße bekommen. Das französische Gesundheitsministerium ordnete den Vertrieb aus Gründen der öffentlichen Gesundheit an. 1991/92 folgte die Markteinführung in Großbritannien und Schweden; 1999 folgten zahlreiche weitere Länder. Hierzulande übernahm die eigens gegründete Hexal-Tochter Femagen den Vertrieb, zog sich jedoch nach wenigen Monaten zurück.
2008 wurde nach einer europaweit gültigen Änderung die Einnahme bis zum 63. Tag der Schwangerschaft erlaubt – statt wie zuvor lediglich bis zum 49. Tag. Gegeben werden 600 mg als Einzeldosis, auch 200 mg sind möglich. Nach 36 bis 48 Stunden werden 1 mg des Prostaglandinanalogons Gemeprost vaginal appliziert; bis zum 49. Tag können stattdessen bei der hochdosierten Mifepriston-Variante alternativ 400 µg Misoprost oral gegeben werden.
Mifepriston blockiert die Effekte des Hormons Progesteron. Innerhalb von 48 Stunden führt dies zu einer Öffnung des Muttermundes und zum Abstoßen der Gebärmutterschleimhaut. Zwei bis drei Tage nach der Einnahme wird durch die Anwendung eines Prostaglandins ein künstlicher Abort ausgelöst.

























APOTHEKE ADHOC Debatte